Podrobno o matičnih celicah
O pomembnosti pluripotentnih matičnih celic je težko pretiravati. Vsak od nas je nekoč bil samo mikroskopski skupek le-teh. Da smo razvili različna tkiva, organe in lahko zdaj strmimo v računalniške zaslone, se lahko zahvalimo edinstveni lastnosti teh matičnih celic, da se lahko diferencirajo. Spremenijo v drug tip.
Že davno je znanstvenikom kanilo: če se te celice lahko prelevijo v različna tkiva, potem bi potencialno lahko z njimi naredili marsikaj. Morda laboratorijsko vzgajali organe? Zdravili ljudi? Obnavljali izrabljene sklepe? Možnosti je ogromno, toda razvoj je težaven, napredek pa drag.
Prav tako ogromen je namreč kup neznank. Dogajanje v celici je sila kompleksno in pretežno neznano. Celica je program z milijoni vrstic "kode" in znanost jih počasi, drugo za drugo razkriva.
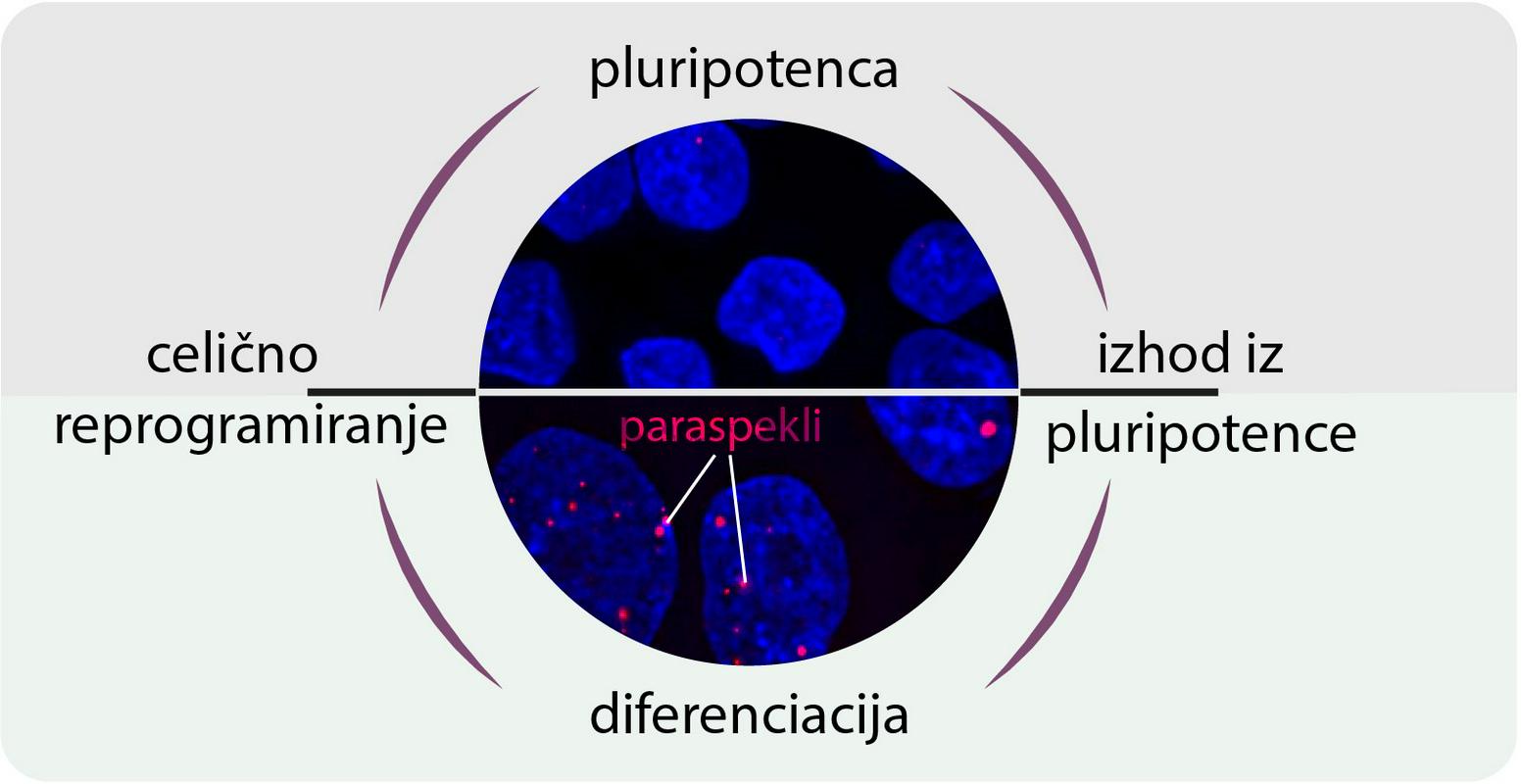
Nekaj vrstic je zdaj razgrnila raziskovalna skupina znanstvenikov z znatnim slovenskim pečatom. Odkrila je, da nediferencirane celice nimajo jedrnih struktur, imenovanih paraspekli, in izsledila način, kako se v spremenjenih celicah pojavijo. Našla je tudi potencialno povezavo med to regulatorno mrežo in težkimi nevrodegenerativnimi boleznimi, kot je amiotrofična lateralna skleroza (ALS).

Raziskava je objavljena v znanstveni publikaciji Molecular Cell.
Kaj se dogaja v tistih najzgodnejših trenutkih
Matične celice so multipraktik, ki človeku služijo celo življenje. Kot rečeno, iz njih se od začetka razvijemo kot zarodek, toda v telesu ostanejo za vselej. Skoraj v vsakem organu so, le za srce in možgane se znanstveniki še prerekajo, ali sta organa opremljena ali ne, je za MMC pojasnil biolog Miha Modic, ki deluje v Londonu. Skrbijo, da se organi regenerirajo.
Dandanes ni treba kirurško šariti po telesu, da bi jih dobili ven, ali pa uporabljati pravih zarodkov. Japonci so namreč v prejšnjem desetletju našli pot, kako ustvariti pluripotentne izvorne celice kar iz "navadnih" celic kože. Za dosežek je bila leta 2012 podeljena Nobelova nagrada za medicino. "To je revolucija v medicini," je povedal sogovornik. "Vzameš pacientove kožne celice ali pa praktično katere koli druge, tudi iz urina, in jih lahko reprogramiraš v plurpotentni material. Dodaš koktajl štirih različnih transkripcijskih faktorjev, ki so značilni za matične celice, in to zadostuje, da privedejo celico v začetni razvojni potencial."
Znanost torej zna celice pripeljati spet na začetek. Ni pa znano, kaj točno jih požene v nasprotno smer. Pluripotentna izvorna celica je kot gimnazijec, ki ne ve, na katero fakulteto naj se vpiše. Na neki točki se pojavi nekaj, kar sproži odločitev. "Mi ne vemo, kaj je tisti prvi trenutek, ki pove celici, ti greš ven, najdi svojo pot. In to smo mi opazovali: kaj so tisti prvi trenutki," je povedal za MMC.
Ugotovitev študije zelo na kratko
Raziskavo je izvedlo kup slovenskih znanstvenikov, ki tesno sodelujejo, čeravno po različnih laboratorijih po svetu. Poleg Modica še biolog Jernej Ule, oba v Londonu, pa bioinformatik Gregor Rot z Univerze v Zürichu, nevroznanstvenica Tjaša Lepko iz Münchna, pa še Boris Rogelj z Instituta Jožefa Stefana. Da bo mera polna, je svoje prispeval študent biokemije Michael Palo iz ZDA, ki je potomec slovenskih izseljencev.
Brez paraspeklov ne gre ...
Kaj so ugotovili? V nediferenciranih izvornih celicah ni paraspeklov, drobnih jedrnih struktur. Paraspekli so naraščajoče 'zvezde' na področju celične biologije, ki so potencialno povezane z naraščajočim seznamom človeških procesov in bolezni, v razvojnem kontekstu pa so slabo raziskane. Nastanejo z razvejitvijo in so torej njen neločljiv faktor.
Le nekaj dni po izvedeni razvejitvi raven paraspeklov upade. Gre torej za kratek, a intenziven dogodek, skoraj šok za celico. Skupino je zanimalo, kaj se zgodi, če ga preprečijo. Izid je bil nedvoumen: embrionalni razvoj se je ustavil. (Zdravo) bitje brez njih ne more nastati.

... pa tudi brez TDP-43 ne
Pojdimo na sam začetek, k navadni, nedifirencirani pluripotentni matični celica. Ta je polna proteina, ki sliši na TDP-43, in prazna paraspeklov. In kot kaže, je TDP-43 tisti "zločinec", ki "gimnazijcu" preprečuje odločitev za prihodnost. Duši namreč nekatere informacijske strukture v celici, tako da jih privlači nase. Ne vežejo se na RNK, ribonukleinsko kislino in zato ne opravljajo svojega dela.
Konkretno: v celici je že od začetka različica RNK-ja, NEAT1, a v kratki obliki. Šele kot začne TDP-43 upadati, ji dovoli podaljšanje, kar pripelje do nastanka prej omenjenih jedrnih peg, paraspeklov.
Obenem pride do povratne zanke. TDP-43 je namreč gradbeni material za paraspekle, kar mu onemogoči njegovo vlogo v drugih celičnih procesih.
"Protein TDP-43 je ena izmed glavnih komponent jedrnih telesc, kar dodatno pospešuje izgubo vloge TDP-43, ki nadzoruje daljšanje in krajšanje tudi več kot tisoč drugih molekul RNK-ja in prav ta globalna vloga je odvisna od nastanka jedrnih telesc. To predstavlja medsebojno zanko med nekodirajočim RNK-jem in proteini, ki določi binarno izbiro med samoobnovitvijo matičnih celic in njihovo diferenciacijo."
Od opisanega dogajanja naprej se matične celice razvejijo na tri tipe: endo-, meso- in eksodermne. Od tam dalje pa v vse, kar sestavlja bitje, ki strmi v računalniški zaslon.
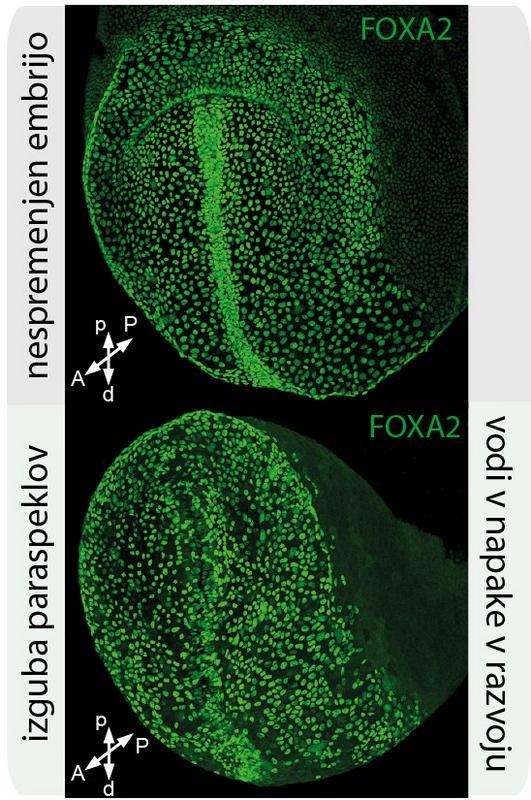
Ko gredo stvari narobe
Medsebojni mehanizem proteina TDP-43 in paraspeklov je še eno področje, kjer lahko gredo stvari narobe. Raziskovalci so pokazali, da permutacije medsebojnega mehanizma vodijo v napake razvoja zarodka, še posebej pri zelo hudi nevrološki bolezni, imenovani amiotrofična lateralna skleroza (ALS). Najbolj tipično se bolezen najprej pokaže z oslabitvijo skupine mišic na enem od udov, nato oslabitev postopno zajame sosednje mišice, mišice na drugi strani telesa in mišice za dihanje, govor, požiranje. Človek konča popolnoma negibljiv. Povprečna doba preživetja bolnikov z ALS-jem od postavitve diagnoze je od tri do štiri leta. In upanja na ozdravitev (za zdaj) ni.
Jedrska redukcija TDP-43 v motornih nevronih, ki jih je prizadel ALS, korelira z nastankom paraspeklov. To predstavlja nov okvir za proučevanje, kako so motnje tega ravnovesja del ALS-ja in drugih bolezni.
"Pri boleznih nevrodegeneracije je TDP-43 glavni faktor, tudi če ni mutiran. Pri okoli 10 odstotkih familiarnega ALS-ja je mutiran, praktično vsem primerom ALS-ja pa je skupno, da je faktor TDP-43 izrinjen iz celičnega jedra," je opisal Modic.
"Te povratne zanke postajajo v biologiji vse zanimivejše, zlasti zdaj, ko vidimo, da so bolezni vse pogosteje večfaktorske in jih ne moremo razložiti samo z enim dejavnikom. Edini način, da jih razumemo, je, da gledamo kompleksnost soodvisnih principov, ki tvorijo neki izkoristek, ki je lahko tudi bolezen."
Z radovednostjo za znanostjo v svet
Modic deluje v Londonu. Sodeluje z biologom Jernejem Uletom, ki ima tam lasten laboratorij in je prav pred kratkim bil nedavno že tretjič izbran za evropsko financiranje v znesku 2,4 milijona evrov za raziskave možganov. Laboratorij je v novonastalem Institutu Francis Crick, ogromni stavbi, kjer je svoj dom našlo 80 laboratorijev z več institucij. Prednost takšne mrežne oblike dela je, da je ogromno strokovnjakov različnih smeri praktično na dosegu roke, zato ni težko najti nekoga, ki je pravšnji za projekt ‒ ali nasvet. Razmere za delo so izjemne in neprimerljive z domačimi, je povedal Modic.

Sogovornik je v Sloveniji sprva študiral pravo in obenem biotehnologijo, nameraval je namreč postati strokovnjak za patentno pravo na tem področju. To ga je zaneslo v München, kjer je ob študiju začel prakso in kaj hitro ugotovil, da je to dolgočasno, raziskovanje pa toliko zanimivejše. Zato se je popolnoma usmeril v biokemijo in zdaj že deset let deluje na tem področju v tujini. Z Uletom je med doktorskim študijem sodeloval že leta 2014, ko je pripomogel pri slovenski objavi v reviji Nature (Kako celica režira film življenja) in kot podoktorski raziskovalec končal v njegovem laboratoriju.
Modic si želi, da bi se lahko nekoč vrnil v Slovenijo kot znanstvenik. A vidi, da je znanstveno raziskovanje tukaj izjemno zaprta dejavnost, saj ARRS večinoma financira programsko, kar pomeni, da gre denar za določene skupine in nove težko pridejo "v sistem". Prav tako je kritičen do sistema točkovanja znanstvenih objav, ki da spodbuja količino, in ne kakovost, in do "kronične nedohranjenosti" znanosti.
Mogoče je marsikaj
Z matičnimi celicami znanost hitro napreduje. Znanstveniki danes lahko spremenijo kožne celice v pluripotentne matične, jih nato usmerijo v beta celice, ki proizvajajo inzulin, in te beta celice bi lahko dodali sladkornemu bolniku v trebušno slinavko. Pri možganih iščejo možnosti, kako jih popravljati po poškodbi, in sicer tako, da na mesto fizične poškodbe presadijo pacientove, v laboratoriju vzgojene nevrone, in jih spodbujajo k vključevanju v sinapse, je ponazoril Modic.
V laboratorijih ustvarjajo minimožgane, organoide človeških jeter, utripajoča človeška srca, tudi 3D-natisnjena ... Dandanes je to predvsem laboratorijski model, ki se lahko uporablja za neposredna testiranja modelov, pa tudi morebitnih zdravil še pred dragimi kliničnimi študijami. Bodo nekoč v laboratoriju regenerirali izgubljeno roko? Ni nemogoče. Treba je le poznati vse vrstice "programske" kode, ki poganjajo naš razvoj.






























































Komentarji so trenutno privzeto izklopljeni. V nastavitvah si jih lahko omogočite. Za prikaz možnosti nastavitev kliknite na ikono vašega profila v zgornjem desnem kotu zaslona.
Prikaži komentarje