Toda kljub temu so nekatere nevarne vrste organizmov razvile načine, da kljub prvim pregradam vdrejo v naše telo. In prav zato imamo imunski sistem. Čeprav je njegovo delovanje zelo zapleteno, ima eno osnovno nalogo: prepoznati tujek, mobilizirati obrambne celice in pripraviti vrsto imunskega odziva. Je kot neke vrste obrambni strateg, ki mora misliti na več stvari hkrati. Po eni strani mora biti dovolj učinkovit, da ustavi okužbo, po drugi pa ravno prav uravnan, da je vnetje – to je eden od imunskih odzivov – čim manj moteče za delovanje organizma. Zato v nekaterih tkivih, kot so prebavna sluznica, možgani, jetra ali očesno zrklo, kjer bi vnetje izrazito ogrozilo organizem, pri prihodu tujkov nastanejo nevnetni imunski odzivi. Podobno se zgodi tudi v primerih, ko v telo pride velika količina tujkov.
Okužba s patogenom – kot da bi bili na bojnem polju
"Ko virus vdre v celico, se površina celice spremeni, naš imunski sistem prepozna, da je nekaj narobe, in celico obravnava kot tujek," pojasni mag. Katarina Prosenc Trilar iz Laboratorija za javnozdravstveno virologijo v Nacionalnem laboratoriju za zdravje, okolje in hrano. "Na pomoč pošlje celice imunskega odgovora, ki viruse in napadene celice nato razgradijo in hkrati opravijo označevanje, označijo sam virus. S tem sprožijo proizvodnjo specifičnih protiteles, kar pa traja več dni." Pri okužbi se najprej sprožijo celice prirojenega imunskega odziva, temu v nekaj dneh sledi še pridobljeni imunski odziv, ki je veliko učinkovitejši in bolj specializiran. Ob tem še omenimo, da virusi za vdor v celice uporabljajo posebne proteine, prek katerih se pripnejo na površino celic in vstopijo v njih. Da jim preprečimo namero, moramo torej onesposobiti te njihove ključne dele.
Da se virus veže na celico in vdre v njeno notranjost, potrebuje le deset minut. V naslednjih desetih urah jo spremeni v svojo tovarno, v tem času lahko ena sama celica proizvede več sto kopij virusa. Alarm najprej prikliče celice ubijalke prirojenega imunskega sistema, ki so na bojnem polju ključne v prvih treh dneh po okužbi, šele dneve zatem prihitijo na pomoč tudi okrepitve, natančno specializirane celice prilagojenega imunskega odziva, ki jih telo pripravi posebej za ta virus. Pravimo jim limfociti in so več različnih vrst, pove imunolog dr. Alojz Ihan, predstojnik Katedre za mikrobiologijo in imunologijo na ljubljanski Medicinski fakulteti.

"V telesu imamo več deset milijonov vrst različnih limfocitov. Značilno za njih je to, da ima vsak od teh, ki izdelujejo protitelesa, svoje receptorje drugače oblikovane. Zakaj? S tem je poskrbljeno, da se bo vedno našlo nekaj limfocitov, ki bodo sposobni imunskega odgovora, ne glede na to, katera koli tuja molekula pride v organizem. A to ima tudi slabo stran: ko v telo vdrejo mikroorganizmi, je teh nekaj deset ali nekaj sto milijonov, mi pa imamo le nekaj deset limfocitov, primernih zanje." Teh nekaj deset limfocitov torej na samem začetku ne more proizvesti učinkovitega imunskega odziva. Toda naš imunski sistem deluje tako, da se primerni limfociti po prepoznavi prve okužbe v naslednjih od 10 do 14 dneh razmnožijo po nekaj tisočkrat ali desettisočkrat, ti pa lahko ustvarijo zadostno količino protiteles in ustavijo okužbo.
Cepljenje posnema naravno okužbo
Telo torej pri vsaki novi okužbi potrebuje kar nekaj dni, da zbere in pomnoži ključne specialne enote in jih pošlje nad nevarno tujo legijo, a kaj ko je 10 dni veliko … in naš organizem lahko vmes podleže. In tukaj lahko stvari olajša cepljenje, ki po svoji osnovni definiciji posnema naravno okužbo, a na veliko manj dramatičen način. "S cepljenjem naredimo enako, kot da bi prvič preboleli okužbo," pojasni Ihan, "imunske celice si razmnožimo do te mere, da lahko ustavijo okužbo. Cepljenje nam prihrani prvo bolezen. Pri nekaterih boleznih je to zelo pomembno, saj lahko te potekajo tako hudo, da močno prizadenejo človeka."
S cepljenjem naredimo enako, kot da bi prvič preboleli okužbo. Imunske celice si razmnožimo do te mere, da lahko ustavijo okužbo. Cepljenje nam prihrani prvo bolezen. Pri nekaterih boleznih je to zelo pomembno, saj lahko te potekajo tako hudo, da močno prizadenejo človeka.
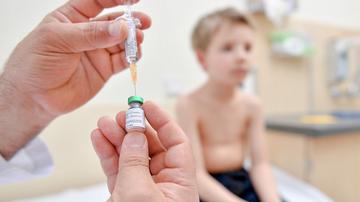
Pri cepljenju torej stvari v principu potekajo na enak način kot pri prvi okužbi, le da brez znakov bolezni. Posebne dendritske celice na mestu vboda prepoznajo tujek, ga – če smo zelo ilustrativni – vklenejo in odvedejo do področnih bezgavk. Tam predstavijo nekatere njegove ključne dele, s katerimi vdira v celice. Kot da bi na mizo zložile njegovo osebno izkaznico in vse vlomilno orožje, ki ga uporablja. Vse to si nato natančno ogledajo tako imenovani limfociti T – celice pomagalke in na podlagi tega se začne razmnoževanje zelo specifičnih celic ubijalk in spominskih celic.
Ko so tujki odstranjeni, ostanejo spominski limfociti še leta dolgo v organizmu. Če nas tujki znova obiščejo, naslednje leto ali čez dve leti, lahko učinkovit protinapad izvedejo takoj in napadalca s tem učinkovito odbijejo. A ker tudi spominske celice v številnih primerih počasi propadajo in po določenem številu let ne patruljirajo več v dovolj velikem številu, so pri nekaterih vrstah cepiva potrebni poživitveni ali obnovitveni odmerki. Z njimi spodbujamo nastajanje novih spominskih celic. "Če imamo pred cepljenjem 10 ali 20 limfocitov B, ki izdelujejo protitelesa, jih s cepivom pridelamo od 100 000 do 200 000. Njihova količina lahko v nekaj letih zdrsne na nekaj 10 000, kar še komaj zadošča za takojšnjo obrambo. Z obnovitvenimi odmerki spominske celice količinsko torej znova dovolj povečamo."
Pri tem je pomembno, kam se cepimo: v podkožju in mišičju imamo veliko dendritskih celic, manj pa jih je v maščobnem tkivu. Cepivo lahko tudi popijemo, a pri tem mora biti narejeno tako, da preživi srečanje z želodčno kislino, po večini gre v takem primeru za oslabljene ali žive atenuirane viruse, veliko obeta tudi snovanje cepiv neposredno za vstavljanje v bolj izpostavljene dele telesa s sluznicami, kot je nosno-žrelni del.
Vloga adjuvansov
Pri tem potrebuje cepivo, ko ga dovedejo v telo, tudi pomoč. Lahko bi se zgodilo, da bi vstopilo v telo, a brez učinka. Telo je treba torej opozoriti na to, da smo na določenem delu vstavili cepivo, da se nanj tudi primerno odzove. Ta vloga pri cepivih pripada drugi najpomembnejši sestavini ob imunogenih – adjuvansom, ki so velikokrat tisti, zaradi katerih nas lahko na mestu vboda še nekaj časa spremlja bolečina.
Po besedah dr. Tomaža Bratkoviča, predstojnika Katedre za farmacevtsko biologijo na Fakulteti za farmacijo v Ljubljani, "gre za snovi, ki same po sebi niso imunogene, ampak okrepijo imunski odgovor proti sočasno apliciranemu imunogenu. Delujejo na tak način, da podaljšujejo zadrževanje imunogena na mestu vnosa v telo oziroma da izzovejo lokalno sproščanje vnetnih dejavnikov, ki privabijo in aktivirajo imunske celice. So bistvenega pomena za novačenje imunskih celic na mesto, kjer smo vnesli cepivo".
Reakcije v smislu avtoimunske bolezni so redki resni neželeni učinki in navadno nastanejo pri ljudeh, ki imajo tudi neko motnjo znotraj imunskega sistema in se zaradi nje na cepljenje odzivajo drugače kot velika večina drugih ljudi. Tega, preden se začne cepivo na široko uporabljati, ne vemo. Zato smo, denimo, izjemno pozorni pri cepljenju otrok, ki imajo v družini že neke imunske bolezni
Adjuvansi torej povečajo imunski odgovor na dano cepivo. Z dodatkom adjuvansov lahko zmanjšamo vsebovano koncentracijo imunogena, pri čemer dosežemo enak zaščitni učinek. Kot klasične adjuvanse uporabljajo aluminijeve spojine, v novejših pa se uvajajo še nekoliko naprednejše spojine, kot so agonisti receptorjev TLR. Hipna tekma za covidna cepiva je tudi dobra priložnost za nadaljnji razvoj adjuvansov, saj ta poteka hkrati z iskanjem novih vrst cepiv.
Poleg imunogena in adjuvansov v cepiva dodajajo še konzervanse, stabilizatorje, antioksidante, soli in seveda vodo.
In kaj od vsega naštetega bi lahko bilo sporno, da se pri določenih razvije hujša reakcija? Bratkovič spomni na možnost sprožitve "alergijske reakcije, a ne nujno na komponento cepiva. Cepivo lahko izzove alergije na nečistote, ki so prisotne v sledovih in so posledica tega, da njegovo osnovno enoto, torej neki rekombinanten protein, pridobivamo v insektni ali sesalski celici, kvasovkah … in to lahko sproži neželeno reakcijo". V izjemno redkih primerih lahko cepivo sproži tudi resne stranske učinke. Ihan to pojasni z "genetskimi posebnostmi ljudi, ki pa jih vnaprej ne vemo in jih še nekaj časa ne bo mogoče presejati. Reakcije v smislu avtoimunske bolezni so redki resni neželeni učinki navadno nastanejo pri ljudeh, ki imajo tudi neko motnjo znotraj imunskega sistema in se zaradi nje na cepljenje odzivajo drugače kot velika večina drugih ljudi. Tega, preden se začne cepivo na široko uporabljati, nikoli ne vemo. Zato smo, denimo, izjemno pozorni pri cepljenju otrok, ki imajo v družini že neke imunske bolezni".
Cepivo ščiti pred boleznijo; kaj pa pred tem, da bi okužbo še naprej širili?
Cepivo nas v svojem bistvu zaščiti pred boleznijo samo. Če se cepimo pred ošpicami, smo torej zaščiteni pred to boleznijo, če proti otroški paralizi, se obvarujemo pred to boleznijo. A obstaja še eno vprašanje: nas cepivo tudi obvaruje pred tem, da bi še naprej prenašali okužbo? Smo lahko kljub cepljenju še naprej prenašalci patogenov? Ni nujno. Taki zaščiti pravimo sterilizacijska imunost, pogosto je zagotovljena takrat, kadar nas cepijo na primer z živimi, a oslabljenimi virusi, pri sodobnejših cepivih pa ne nujno. Kot pravi imunolog dr. Alojz Ihan, "sterilizacijsko imunost praviloma izzovejo predvsem s cepivi, ki vsebujejo žive, a oslabljene viruse. Ti sprožijo nastanek raznovrstnih odzivov po telesu, ki v nadaljevanju ne dopustijo pasivne naselitve mikroorganizmov". Sterilizacijska imunost torej pomeni, da človek, ki je bil cepljen, ni le zaščiten pred boleznijo, ampak s svojim imunskim odzivom tudi preprečuje, da bi postal razširjevalec okužbe.
Pri iskanju cepiva proti covidu je po Ihanovih besedah za zdaj "glavno merilo, ali cepivo prepreči nastanek covida. To bo tudi edino merilo, ki ga bodo pristojni regulatorni organi upoštevali pri presoji prijave za dovoljenje". Dozdajšnji poskusi na živalih pri številnih kandidatnih cepivih niso potrdili, da bi cepivo preprečilo tudi širjenje okužbe.
Dodatne prednosti cepiv
Okrog 60. oziroma 70. leta upade proizvodnja limfocitov B v kostnem mozgu, pri moških prej, pri ženskah pozneje. Cepljenje po tem obdobju postane razmeroma slabo učinkovito. Če je učinkovitost cepiva proti gripi za odrasle približno od 60- do 70-odstotna, se po 65. letu ta odstotek zmanjša na od 30 do 40 odstotkov.
Ob bok opisu delovanja cepiv na naš imunski sistem pa omenimo še eno ugotovitev, staro že skoraj stoletje. Že v 30. letih prejšnjega stoletja, ko so začeli otroke cepiti proti tuberkulozi, so ugotovili, da so imeli dojenčki, ki so bili cepljeni proti tej bolezni, manj bakterijskih okužb v primerjavi s tistimi, ki niso bili cepljeni, je povedal infektolog in pediater dr. Marko Pokorn iz ljubljanske Pediatrične klinike. "Tudi novejše raziskave so prišle do podobnih rezultatov, ugotovili so, da so bile sepse pri novorojenčkih, ki so bili cepljeni proti tuberkulozi, manj pogoste. Očitno to cepivo 'trenira' otrokov imunski sistem in ga naredi zmogljivejšega, da se spoprime z izzivi iz zunanjega okolja, s katerimi se otrok spopada po rojstvu."
Imunsko staranje se začne že zelo zgodaj
Po besedah imunologa Alojza Ihana je starost enega leta približno tista meja, ko naj bi imunski sistem pri posamezniku dozorel. "Do prvega pol leta starosti ima dojenček zelo veliko materinih protiteles in to ni najugodnejše za cepljenje. Protitelesa na sestavine cepiva lahko namreč zmanjšajo njegovo učinkovitost." Prvo pomembnejšo mejo pri imunskem sistemu posameznika predstavlja obdobje od 25. do 30. leta starosti. "To je tista meja, ko izgubimo funkcijo priželjca. Do takrat ga imamo nad srcem kot pomemben imunski organ, ki proizvaja nove limfocite T. Ta proizvodnja se neha ravno v tej starosti in od takrat naprej nimamo več novih limfocitov T, ki bi se dobro prilagajali na nove okužbe, ampak živimo bolj ali manj na račun imunskih spominov." Že tako zgodaj v človekovem življenju postane imunska odzivnost torej manj kakovostna, kot je bila prej.
Druga pomembna meja pa je po njegovih besedah okrog 60. oziroma 70. leta. "Takrat upade proizvodnja limfocitov B v kostnem mozgu, pri moških prej, pri ženskah pozneje. Cepljenje po tem obdobju postane razmeroma slabo učinkovito. Če je učinkovitost cepiva proti gripi za odrasle približno od 60- do 70-odstotna, se po 65. letu ta odstotek zmanjša na od 30 do 40 odstotkov. V tej starosti torej močno upade kakovost odzivanja na cepiva."
Fascinantno potovanje do sodobnih vrst cepiv
Cepiva bi lahko v grobem delili na klasična in sodobnejša, ta so z nami že nekaj desetletij. Med klasičnimi poznamo mrtva ali inaktivirana in živa oslabljena ali atenuirana.
Številna klasična cepiva so še danes med najučinkovitejšimi
Oče sodobne mikrobiologije Louis Pasteur je, kot smo omenili že v prvem članku, med preučevanjem kolere pri piščancih odkril, da vbrizgavanje oslabljenih bakterij pri živalih ne povzroči bolezni, prepreči pa njen pojav, ko jih pozneje okužimo z živimi bakterijami. Na tak način se je rodila zamisel mrtvih ali inaktiviranih cepiv, ki so jih pripravili tako, da so povzročitelje bolezni izpostavili visoki temperaturi ali jih obdelali s formalinom. "Tako so že pred prvo svetovno vojno nastala cepiva za kolero, tifus, antraks, steklino, črne koze … Vse do druge svetovne vojne je prevladoval princip izdelovanja cepiv na tak način," pojasnjuje Alojz Ihan.
Po drugi svetovni vojni se je zgodil nov premik. Viruse so začeli gojiti v kulturah, "pri tem pa so opazili, da se ti prilagodijo gojišču, če se jih velikokrat preceplja na denimo isti miški, in taki virusi pogosto postanejo manj nevarni, nepatogeni. Izgubijo gene, ki jim omogočajo, da bi v telesu povzročili resno okužbo." Na tak način se je rodila naslednja velika skupina cepiv: živa, a oslabljena oziroma atenuirana. Ta spodbodejo najmočnejši imunski odziv, zato so tudi najučinkovitejša. Mrtva cepiva so tista, s katerimi se zavarujemo proti klopnemu meningitisu, steklini, mednje uvrščamo tudi določene vrste cepiv proti otroški paralizi …, cepiva z oslabljenimi virusi pa so na primer tista proti rdečkam, rotavirusnim okužbam, ošpicam, mumpsu, noricam in tako naprej. Živa cepiva se v telesu razmnožujejo kot pravi patogeni, zato spodbudijo nastanek dolgotrajnega imunskega spomina.
Po besedah dr. Tomaža Bratkoviča, ki na Fakulteti za farmacijo v Ljubljani vodi katedro za farmacevtsko biologijo, so prav "oslabljena ali atenuirana gotovo ena od boljših, z njimi so učinkovito zajezili ošpice, mumps, rdečke … Njihova slabost pa je, da je razvoj razmeroma dolgotrajen, zagotoviti je treba varnost. Ta cepiva razvijajo z večkratnim dolgotrajnim precepljanjem, kot neke vrste klasično žlahtnjenje rastlin, kjer izbirate tiste seve, ki imajo optimalne lastnosti."
Od virusov pismonoš do najsodobnejših RNK-cepiv
Od sredine 80. let prejšnjega stoletja so na pohodu sodobnejše oblike cepiv, ki jim lahko skupno rečemo rekombinantna. Ta cepiva po besedah Bratkoviča proizvajajo "s pomočjo genskega inženirstva, poudarek je na pripravi posameznih strukturnih delov virusa, pri tem izdelajo zapisan protein in ga uporabijo kot glavno komponento cepiva". Po večini se osredotočajo na tiste površinske proteine, ki jih virusi uporabljajo za vezavo in vstop v celico. Pri koronavirusih SARS-CoV in MERS-CoV se je tako izkazalo, da je površinski protein bodice S zelo dober imunogen za razvoj cepiva. "Osredotočijo se torej na tisti protein, ki ga moramo nevtralizirati, da virus ne bo povzročal okužb. Virus ima ključ za vstop v celico, če najdemo ta ključ, ga lahko 'zamaskiramo' in tako virus ne bo mogel vdreti v celico," je ob tem dodal dr. Roman Jerala, vodja Odseka za sintezno biologijo in imunologijo na Kemijskem inštitutu v Ljubljani.
Še sodobnejša so vektorska cepiva, pri katerih pomembno vlogo igrajo mikroorganizmi, navadno virusi, ki s povzročiteljem bolezni niso povezani. Proizvajalci takšnega cepiva izkoriščajo sposobnost virusnega vektorja, da s svojim površinskim proteinom prepozna celični receptor in se veže nanj, kar mu omogoči dostavo tovora (nukleinske kisline z genom za imunogen določenega povzročitelja bolezni) v celico. Delujejo torej kot dostavni sistemi ali kot neke vrste pismonoše, ki v celice učinkovito vnesejo genski zapis za želeni protein, ki ga nato celice ob pomoči zapisa tudi izdelajo in ga predstavijo lastnemu imunskemu sistemu.
"Zelo podobno delujejo tudi cepiva na podlagi RNK ali DNK. Gre za vnos genske informacije, ki pripada povzročitelju bolezni, vse to pa potem izdelajo naše celice." V zadnjih mesecih so prav cepiva na podlagi RNK prejela največ pozornosti, strokovno se jih je oprijelo ime 'platforma mRNK' ali po tuje mRNA. Tako Pfizerjev kandidat kot kandidat Moderne sta namreč RNK-cepivi. Če se izrazimo zelo poenostavljeno, takšna cepiva delujejo tako, da v svoje telo vnesemo samo načrt orožja, ki ga uporablja nevarni koronavirus. Torej ne koronavirusa samega ne njegovih proteinov, s katerimi si odklenejo pot v celice, ampak samo načrt, kako sestaviti proteine, ki sprožijo imunski odziv v telesu.
O RNK cepivih
RNK-cepiva še brez licence, jih pa na ljudeh preizkušajo že vrsto let
RNK-cepiva so popolna novost, na podlagi RNK namreč doslej še nimamo registriranega cepiva. "Doslej je bilo največ cepiv v uporabi izdelanih na podlagi oslabljenega ali inaktiviranega virusa," je potrdil tudi dr. Florian Krammer sicer Avstrijec, ki na newyorški šoli medicine Icahn Mount Sinai predava vakcinologijo, pred kratkim pa je v reviji Nature izdal pregleden članek o aktualnih cepivih proti covidu. "Toda po drugi strani so v zadnjih letih podelili veliko licenc cepivom na podlagi rekombinantnih proteinov, tako je na primer cepivo proti gripi, ki se uporablja v Združenih državah, ali pa cepivi proti hepatitisu B oziroma proti HPV. Ta tehnologija je bila torej v zadnjih letih precej v uporabi. V Evropski uniji sta licenco v preteklosti pridobili dve cepivi na podlagi virusnih vektorjev, obe proti eboli. Doslej smo torej dobili kar veliko podatkov tako o varnosti kot o učinkovitosti takšnih vrst cepiv. Res pa je, da cepiva na podlagi RNK še niso dočakala prve licence, a so se prav tako v preteklih letih razvijala in prebijala skozi klinične stopnje." Na tem področju se je v preteklosti najbolj izpopolnila prav Moderna, ki cepiva na podlagi RNK razvija proti gripi, čikungunji in tako naprej. Tudi to tehnologijo so doslej že preizkusili na številnih ljudeh.
"Glavna prednost novejših cepiv je v tem, da so modularna. Platformo poznamo in vse, kar je treba narediti, je, da zamenjamo košček genskega zapisa. Pri tem se vedejo bolj ali manj podobno, ne glede na to, kaj vnesemo v organizem," je dodal Bratkovič. Čeprav so nam za zdaj še neznanka, predstavljajo RNK- in DNK-cepiva velik obet, poudarja tudi dr. Roman Jerala. Nukleotidno zaporedje virusa SARS-CoV-2 je bilo znano že 10. januarja, že nekaj dni zatem so podjetja že izbrala zaporedja, ki so jih uporabila v prvih cepivih. "Predvsem je njihova prednost v tem, da jih lahko zelo hitro pripravimo. Pri podjetju Moderna so imeli ob izbruhu koronavirusnih okužb platformo za cepivo že pripravljeno, treba je bilo le spremeniti nukleotidno zaporedje in so lahko takoj prešli na testiranje na ljudeh. Pomagale so predhodne izkušnje z dvema sorodnima virusoma MERS ter SARS-CoV. Takšno cepivo je bilo že preizkušeno, vedeli so, da sama RNK, sama formulacija nima škodljivih učinkov, razlika je le v zaporedju RNK. To omogoča bistveno hitrejši razvoj cepiva in njegovo adaptacijo." Podobno po njegovem mnenju velja za vsa cepiva, ki vsebujejo nukleinske kisline – tako RNK- in DNK-cepiva kot cepiva, ki temeljijo na adenovirusih.
Roman Jerala o RNK-cepivih:
Takšna cepiva bodo zagotovo najperspektivnejša zlasti v primerih, če virus opazneje mutira. Nedavno je odmevala novica o tem, da je koronavirus SARS-CoV-2 ob preskoku med ljudmi in kunami na Danskem mutiral. V takih primerih je stava na takšna cepiva še toliko bolj praktična in izvedljiva, se strinja Jerala. "Relativno preprosto bi bilo spremeniti zasnovo takšnih cepiv. Ob tem ne bi bila potrebna prva stopnja kliničnega testiranja za preverjanje varnosti, ampak bi lahko neposredno testirali učinkovitost." Mutacija, ki so jo odkrili na Danskem, naj ne bi bila problematična za že razvita in preverjena cepiva. Za zdaj ni dokaza, da bi kakor koli vplivala na učinkovitost cepiv, ki so tik pred odobritvijo.
Kam se bo usmerila znanost o cepivih?

Po besedah Jerale je k hitremu napredku sodobnejših vrst cepiv veliko prispeval "razvoj molekularne biologije, zelo pomembno pa je tudi razumevanje same imunologije, torej to, da bolje razumemo, kaj naredi neko cepivo učinkovitejše". Na področju vakcinologije je po njegovem mnenju še veliko neodgovorjenih vprašanj, za veliko bolezni, ki jih povzročajo patogeni, še vedno ne poznamo cepiva. "V precejšnji meri je to odvisno od patogena, nekateri namreč zelo hitro mutirajo. Za nevtralizacijo virusa ali patogena je treba tvoriti nevtralizacijska protitelesa, ki so najučinkovitejša. In pri določenih patogenih je zelo težko sprožiti tvorjenje teh protiteles." Sodoben pristop vakcinologije skuša po njegovih besedah bolje spoznati zorenje imunskega sistema in ga usmerjati v točno določeno smer, ki bo dala želen odziv. "K sreči", doda, "novi koronavirus ni tako zelo trd oreh."
In kateri kandidati, ki jih ta hip razvijajo proti koronavirusni bolezni, so njegovi favoriti? "RNK-cepivo je eno od teh. Cepiva na podlagi adenovirusov so bolj reaktogena, sprožijo močnejšo reakcijo, cepiva na podlagi proteinov pa so na živalskih študijah pokazala najmočnejše titre, a traja dlje, da se razvije proces proizvodnje, ki je od cepiva do cepiva drugačen. Po večini so še pred tretjo klinično stopnjo, je pa to tista tehnologija, ki je ta hip najbolj uveljavljena pri odobrenih sodobnih cepivih. Sam sem zelo vesel, da se je cepivo na podlagi RNK za zdaj izkazalo za uspešno. Doslej je veljalo predvsem kot nekakšna rezerva, a mislim, da se bodo takšna cepiva v prihodnje precej bolj uporabljala."
Podrobneje o kandidatnih cepivih proti covidu-19
Pri razvoju cepiv proti koronavirusni bolezni prevladujejo rekombinantna proteinska cepiva. Nekaj jih je tudi že v tretji klinični stopnji razvoja. Primer je cepivo podjetja Novavax iz Marylanda v ZDA. Med najperspektivnejšimi so kandidati, ki temeljijo na mRNK. Tu sta bili v zadnjem obdobju v ospredju cepivo podjetij BioNTech in Pfizer ter cepivo ameriškega podjetja Moderna, ki je nastalo v sodelovanju z ameriškim nacionalnim inštitutom za zdravje. Obe cepivi sta v sklepu tretje stopnje kliničnih testiranj. Pri Pfizerju so testiranje izvedli v kar šestih državah (Argentini, Braziliji, Nemčiji, Južni Afriki, Turčiji in Združenih državah Amerike), v Moderni pa v Združenih državah Amerike. Omejitev teh cepiv sta hramba in transport, ki vključuje hladilnike, ohlajene tudi pod -70 stopinjami Celzija. Po napovedih naj bi cepivi v Evropi dobili dovoljenje za trg v nekaj tednih, medtem je britanski regulator MHRA na začetku meseca Pfizerjevo cepivo že odobril.
Med vektorskimi cepivi sta v ospredju pozornosti cepivo oxfordske univerze in podjetja AstraZeneca ter rusko cepivo Sputnik, s katerim so ta konec tedna v Rusiji že začeli cepiti prve ljudi.
Poleg omenjenih so v tretji stopnji kliničnih raziskav še tri druga vektorska cepiva. Ob vseh naštetih pa so v tretji klinični stopnji še štiri tako imenovana mrtva oziroma inaktivirana cepiva.
















































 2. sv
2. sv




Komentarji so trenutno privzeto izklopljeni. V nastavitvah si jih lahko omogočite. Za prikaz možnosti nastavitev kliknite na ikono vašega profila v zgornjem desnem kotu zaslona.
Prikaži komentarje