V prihodnosti se bo verjetno najprej razvilo področje delnih nosilcev – umetnih ali naravnih, katerih uporaba bo omogočala popravilo poškodovanih delov srca, pozneje pa verjetno tudi proizvodnja celotnih organov v laboratoriju.
V teoriji je celoten postopek zelo preprost. Najprej z darovanih organov (ne nujno človeških) odstranimo vse celice in tako pridobimo proteinski nosilec, na katerega nasadimo matične celice, ki so bolniku imunsko skladne.
V praksi pa se znanstveniki srečujejo z mnogimi izzivi. V laboratoriju so že uspešno vzgojili in presadili preproste votle organe (traheja, kirurg Paolo Macchiarini z Univerze v Barceloni, mehur prof. Atala iz ZDA). Vzgajanje bolj zapletenih organov, kot so ledvice ali pljuča, pa pomeni, da mora na pravih mestih biti več deset različnih vrst celic, hkrati pa moramo vzgojiti tudi vsestransko mrežo krvnih žil, ki celice preskrbujejo s kisikom in hranili. Ti organi morajo biti sterilni, sposobni rasti s bolnikom, če jih presadimo otrokom, in sposobni regeneracije. Najpomembneje je, da delujejo – idealno skozi celo življenje.
Srce je tretji najbolj potrebovan organ (za ledvicami in jetri). Samo v ZDA je na čakalni listi za presaditev srca 3500 bolnikov. Njegov razvoj v laboratoriju je zelo zahteven. Na dan prečrpa približno 7000 litrov krvi, sestavljeno je iz več votlin ter zaklopk in različnih vrst celic.
Pri razvoju srca v laboratoriju so pomembni trije ključni dejavniki: nosilec, celice in funkcija celic oziroma pogoji, s katerimi lahko ustvarimo celice, ki so po funkciji enake tistim v normalnem srcu.
Nosilec
Že več kot desetletje znamo v laboratoriju zarodne matične celice spremeniti v utripajoče srčno-mišične celice, z zunanjimi električnimi signali lahko utripanje teh celic tudi sinhroniziramo. V organu so te celice urejene v ustrezno strukturo, ki je tako zapletena, da je 3D-tiskalniki še ne morejo natisniti. Zato je trenutno vodilna uporaba decelulariziranih src – z matriksa s posebnimi postopki v laboratoriju odstranijo vse celice (spletna povezava do filma, ki to prikazuje). Skozi srčne žile več dni črpajo detergent. Na ta način odstranijo lipide, DNA, topne proteine, sladkorje in skoraj ves celični material. Ostane mreža, sestavljena iz kolagena, laminina in drugih strukturnih proteinov – to imenujemo zunajcelični matriks. Nosilec ni treba, da je človeški, zelo obetavni so prašičji. S preizkušanjem različnih pogojev v postopku decelularizacije so razvili zelo uspešno metodo za pripravo ustreznih nosilcev. Vendar je to šele prvi korak, v naslednjem je treba na nosilec nasaditi človeške celice.
Celice
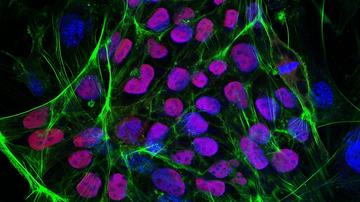
Pri nasaditvi celic se najprej srečamo z več vprašanji: Katere celice uporabiti? Koliko celic potrebujemo? Ali naj uporabimo zrele celice, zarodne matične celice ali celice iPS (inducirane pluripotentne matične celice)? Vsaka vrsta celic ima svoje slabosti in prednosti. Pri uporabi odraslih celic je težava njihova omejena sposobnost za namnoževanje. Večina raziskovalcev uporablja mešanico več vrst celic – npr. endotelne predniške celice, ki so pomembne za razvoj žil in mišične predniške celice, ki tvorijo srčno mišico. Te celice lahko pridobijo z diferenciacijo celic iPS. V teoriji lahko iz celic iPS pridobimo vse vrste celic, ki jih potrebujemo v srcu, ki so hkrati imunsko skladne z bolnikom. V praksi se srečamo s težavo, kako v laboratoriju vzgojiti več milijard celic, ki jih potrebujemo za nasaditev nosilca. Razvoj na področju celičnih kultur gre v avtomatizacijo gojenja celic, kar bo verjetno v prihodnosti, ko bo ta tehnologija cenovno dostopnejša, rešilo to težavo.
Celice se torej pritrdijo na nosilec, začno se deliti in diferencirati. Da celice postanejo funkcionalne, utripajoči karidomiociti, je treba več kot le gojilni medij z rastnimi dejavniki. Zelo pomembno je namreč okolje, ki s svojo trdoto, obliko, mehanskim stresom in drugimi lastnostmi pomembno vpliva na celice in jih usmeri v določeno razvojno smer. Ko nosilec naselijo s celicami, ga naprej gojijo v napravi, imenovani bioreaktor, ki posnema pogoje, ki nastanejo z utripanjem srca. Uporabljajo tudi električne signale, s katerimi uskladijo utripanje srčnih celic (podobno kot delujejo srčni spodbujevalniki) ter črpalko, ki fizično posnema gibe ob utripanju.
Dr. Doris Taylor z Inštituta za srce v Teksasu (Texas Heart Institute) se ukvarja s tkivnim inženirstvom srca, ki bi ga lahko uporabljali za presaditve brez strahu pred zavrnitvijo. Poroča, da so po 8 do 10 dneh umetna srca sposobna utripati sama. Na začetku je tako srce imelo približno 2 odstotka črpalne funkcije normalnega odraslega podganjega srca. Od takrat jim je z izboljšavami in optimizacijo postopkov uspelo doseči 25 odstotkov normalne funkcije pri podganah in drugih večjih sesalcih.
Utrip
Na koncu v laboratoriju vzgojeno srce presadimo bolniku. Prva težava na tem koraku je integriteta žil. Pomembno je, da je endotelij (notranja plast) žil intakten, da ne prihaja do puščanja in tvorbe strdkov, ki so lahko usodni za organ ali za prejemnika. Srca iz laboratorija so v različnih poskusih presadili živalim v vrat, trebuh ali poleg njihovega srca. Pokazali so, da ti organi lahko utripajo, vendar pa še niso sposobni prevzeti celotne črpalne funkcije.
Za MMC dr. Mojca Jež, univ. dipl. biotehnologinja
Predlogi
Ni najdenih zadetkov.
Rezultati iskanja
Rezultati iskanja
Rezultati iskanja
Rezultati iskanja
Rezultati iskanja
Rezultati iskanja
Rezultati iskanja
Rezultati iskanja
















































 2. sv
2. sv



















Komentarji so trenutno privzeto izklopljeni. V nastavitvah si jih lahko omogočite. Za prikaz možnosti nastavitev kliknite na ikono vašega profila v zgornjem desnem kotu zaslona.
Prikaži komentarje